https://romanbystrianyk.substack.com/p/the-vaccine-mistake-nobody-talks
Kimsenin Bahsetmediği Aşı Hatası
DTaP Bir Neslin Bağışıklık Sistemlerini Nasıl Yanlış Programlamış Olabilir
“Boğmaca vakalarının çoğu nispeten hafiftir. Bu tür vakaların yüksek bir şüphe indeksi olmadan teşhis edilmesi zordur, çünkü doktorların tek semptom olabilecek karakteristik öksürüğü duyması pek olası değildir. Ebeveynlere ciddi bir sonucun olası olmadığı konusunda güvence verilebilir. Yetişkinler de özellikle çocuklarından boğmaca geçirirler ve çocuklarla aynı semptomları gösterirler.”[1]
—D Jenkinson, 1995
“...özellikle hastalığın giderek hafifleyen doğası ve ölüm oranının çok küçük olması göz önüne alındığında, boğmacaya karşı evrensel aşılamanın her zaman haklı olup olmadığı sorgulanabilir. En azından İsveç'te bunun yararlarından şüpheliyim ve aynı sorunun başka ülkelerde de ortaya çıkabileceğini düşünüyorum. Modern bebeğe çok sayıda enjeksiyon yapılması gerektiğini ve bunların sayısının azaltılmasının açık bir avantaj olacağını da unutmamalıyız.”[2]
—Justus Ström, 1960
“22 itibarıyla, grip aşılarıyla ilgili 60 yılı aşkın deneyimin ardından, aşının enfeksiyonu önlemesinde çok az iyileşme kaydedildi. Onlarca yıl önce işaret edildiği ve bugün de geçerli olduğu gibi, en iyi onaylanmış grip aşılarımızın etkililik oranları, aşıyla önlenebilir diğer hastalıkların çoğunun ruhsatlandırılması için yetersiz olacaktır...Tüm bu faktörler dikkate alındığında, ağırlıklı olarak mukozal solunum yolu virüslerinin hiçbirinin aşılarla etkili bir şekilde kontrol edilememesi şaşırtıcı değildir... Sistemik olmayan mukozal solunum yolu virüslerine karşı yüksek ölüm oranlarına sahip dayanıklı koruyucu aşılar şu ana kadar aşı geliştirme çabalarından kaçmıştır.”[3]
—Morens, Taubenberger ve Fauci, 2023
DTaP aşısı 1990'larda piyasaya sürüldüğünde, eski tam hücreli boğmaca aşısına daha güvenli bir alternatif olarak selamlandı. Bu karakterizasyon tasarımından kaynaklandı: DTaP, Bordetella pertussis bakterisinin saflaştırılmış bileşenlerini içerirken, tam hücreli DTP aşısı, inaktive edilmiş tam bakterileri kullandı. Halk sağlığı yetkilileri, çocukları boğmacadan korurken yan etkileri azaltacağını umuyordu (or Pertussis—that's “P” ve DTP ve DTaP“'deki zayıflatılmış Pertussis ”aP).
Ancak farkına varmadıkları veya en azından tam olarak anlamadıkları şey—, bu değişikliğin çocuğun bağışıklık sisteminin hastalığa karşı tepkisini ömür boyu kalıcı olarak değiştirebileceğiydi. Doğru okudunuz, “for life.”
Ve kimse bundan bahsetmiyor.
Sorun: “Orijinal Antijenik Sin”
İmmünolojide orijinal antijenik günah adı verilen bir kavram vardır. Bağışıklık sisteminizin karşılaştığı bir virüsün veya bakterinin ilk versiyonuna “stick”'e nasıl eğilimli olduğunu ifade eder. O version—'in hafızasını oluşturuyor ve daha sonra benzer bir şey gördüğünde, öyle olmasa bile sanki aynıymış gibi tepki veriyor. Bu, gelecekteki enfeksiyonlara karşı bağışıklık tepkisini zayıflatabilir.
“Gripte orijinal antijenik günah kavramı 60 yıldan fazla bir süre önce önerildi. Çocukların immünolojik hafızası öyledir ki, ikinci bir influenza A enfeksiyonu ile, ana antikor tepkisi, yeni enfeksiyon suşuna değil, orijinal olarak enfekte oldukları suşa yöneliktir.”[4]
Bu, grip araştırmalarında iyi bilinmektedir— ancak artık bunun boğmaca ve DTaP aşısı için de geçerli olabileceğini biliyoruz.
Araştırmanın Bulduğu
2019 tarihli bir makalede boğmaca uzmanı Dr. James D. Cherry, kids’ bağışıklık sistemlerinin DTaP ile aşılanıp aşılanmadığına bağlı olarak boğmaca bakterilerine nasıl tepki verdiğini tartıştı.
“...adenilat siklaz toksini (ACT) üzerine yapılan bir çalışmada yazarlar, primer B boğmaca enfeksiyonu olan çocukların ACT'ye karşı güçlü bir antikor tepkisine sahip olduğunu belirtmişlerdir. Buna karşılık, dtap aşısı başarısız olanlarda ACT'ye verilen antikor tepkisi köreldi. O zamanlar yazarlar bunun influenza.“'deki ”orijinal antijenik sin”'e benzer olduğunu öne sürdüler[5]
Olan çocuklar aşılanmamış ve doğal bir boğmaca enfeksiyonu geçirdi, adenilat siklaz toksini (ACT) adı verilen önemli bir toksine karşı güçlü bir bağışıklık tepkisi oluştu. Ancak DTaP aşısı başarısız olan çocuklar (, yani hastalandıkları anlamına gelir), ACT'ye körelmiş bir tepki verdi. Bağışıklık sistemleri olması gerektiği gibi tepki vermedi.
Dr. Cherry bu fenomeni orijinal antijenik günahla karşılaştırdı. DTaP aşısı, bağışıklık sistemini boğmaca bakterisinin ( yerine yalnızca birkaç saflaştırılmış kısmına maruz bıraktığından, dar bir bağışıklık hafızası oluşturur. Gerçek bir enfeksiyon daha sonra vurduğunda, vücut onu tam olarak tanımaz veya buna tepki vermez.
Bu, çocukken DTaP alan herkesin hayatlarının geri kalanında boğmacaya karşı daha savunmasız olduğu anlamına gelebilir.
Kolay Düzeltmesi Olmayan Bir Hata
Dr. Kiraz açıktı:
“Bağlantılı epitop baskılanması nedeniyle, DTaP aşılarıyla hazırlanan tüm çocuklar yaşamları boyunca boğmacaya karşı daha duyarlı olacaktır, ve bu artan yaşam boyu duyarlılığı azaltmanın kolay bir yolu yoktur.”[6]
Burada “linked-epitop supression”, “orijinal antijenik sin.” demenin başka bir yoludur
Bu ağır bir ifade.
Bu, aşının uzun vadeli bir bağışıklık dezavantajı yarattığı ve bunu tersine çevirmenin basit bir yolu olmadığı anlamına geliyor.
Peki halk sağlığı yetkililerinin çözümü nedir?
Daha fazla çekim.
Bu büyük tasarım kusurunu kabul etmek yerine, sadece daha fazla güçlendirici öneriyorlar. Dr. Cherry, çocukken DTaP alan ergenlere ve yetişkinlere her üç yılda bir Tdap aşısı yapılmasını bile öneriyor—Ömür boyu her üç yılda bir Tdap.
Ancak bu, altta yatan sorunu çözmüyor. Bu sadece hasar kontrolü.
Halka Hiç Söylenmedi
Bu, yutulması en zor kısımdır: doktorlar size bağışıklık sisteminizin yanlış programlandığını söylemez. Orijinal DTaP aşısının sizi ömür boyu eksik korumaya hazırlamış olabileceğini açıklamıyorlar. Sadece programa daha fazla güçlendirici eklemeye devam ediyorlar.
Ve ortalama bir ebeveynin bunun olduğuna dair hiçbir fikri yok.
Herkes Bu Hatayı Anlamalı
Bu bir komplo teorisi değil—it tıp literatüründe var. Bilim adamlarının nasıl daha güvenli bir aşı yapmaya çalıştıklarını ancak yanlışlıkla insanları nasıl yaptıklarını anlatan hikaye daha az uzun vadede korunmak söylenmesi gereken bir şeydir. Benim sözüme inanmayın, dünyanın en iyi boğmaca uzmanlarından birinin araştırmasının tamamını buradan okuyun:
J. D. Kiraz, MD,“Boğmaca ve Boğmaca Aşılarının 112 Yıllık Odyssey'i—Yapılan Hatalar ve Geleceğe Etkileri,” Pediatrik Bulaşıcı Hastalıklar Derneği Dergisi, Eylül 2019, s. 334–341, https://sboh.wa.gov/sites/default/files/2022-01/Tab09e-Cherry%20JPIDS%202019.pdfOkuyun. Onunla otur. Sorular gelsin.
Bu kadar önemli bir gözetim nasıl bu kadar uzun süre gözden kaçabilir?
Neden bize 'daha güvenli' bir aşı yapmaya çalışmanın insanları terk etmiş olabileceği söylenmedi daha az uzun vadede korunuyor?
Halk sağlığı yetkililerimiz biliyor muydu? Şimdi biliyorlar mı? Ve eğer do— iseler neden kimse bir şey söylemedi?
Bu uç spekülasyon değil. Dünyanın en iyi boğmaca uzmanlarından birinin hakemli bilimidir. Peki sessizlik neden?
Araştırmayı okuyun. Eleştirel düşün. O zaman cevapları hak eden soruları sormaya başlayın.
Kapanışta
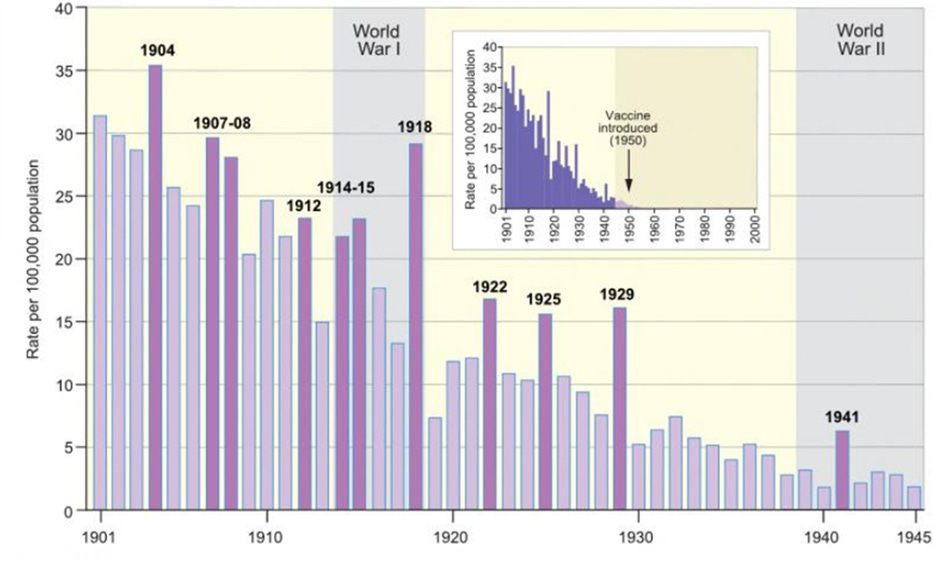
Size asla söylenmeyen şey, boğmaca ölümlerinin DTP aşısının kullanıma sunulmasından önce zaten dramatik bir şekilde düştüğü. Ve yine de, kimse neden ilgilendiği görünmüyor.
Şurada belirtildiği gibi Salgın Britanya Atlası matthew Smallman-Raynor ve Andrew Cliff tarafından,
“Boğmaca eğilimleri, 1901-45. Çubuk grafik, İngiltere ve Galler için 100.000 nüfus başına yıllık ölüm oranları serisini göstermektedir. Altta yatan eğilime göre alışılmadık derecede yüksek ölüm oranlarına sahip örnek yıllar, koyu mor çubuklarla tanımlanır. Ekteki grafik, ana grafiğin kapsadığı dönemi yüzyıllık perspektifle, 1901-2000 yılları arasında göstermektedir. Yirminci yüzyılda İngiltere ve Galler'de boğmacadan toplam 233.698 ölüm kaydedildi ve bunların yüzde 97'sinden fazlası 1901-45 döneminde meydana geldi. Kaynak: Ölüm İstatistikleri Birimi (2003).”'den veriler[7]
Bu tarihsel veriler, sanitasyon, beslenme ve genel halk sağlığı önlemlerindeki iyileştirmelerin, aşıların yaygın olarak kullanılmaya başlanmasından çok önce ölüm oranlarının azaltılmasında muhtemelen çok önemli olduğunu gösteriyor. Ölümlerdeki düşüş zaten oldukça iyi bir şekilde devam ediyordu, ancak yine de odak noktasının büyük kısmı tek kurtarıcı olarak aşılamaya odaklanıyor. Tarihin bu hayati parçası neden gözden kaçırılıyor? Bu büyük ölçüde keşfedilmemiş bir soru.
Aşı bilimi hakkında dürüst konuşmaların zamanı geldi—, yalnızca başarılarının eleştirisiz kutlamaları değil, aynı zamanda başarısızlıklarının net bir şekilde incelenmesi. DTaP aşısının hikayesi iyi niyetlerden, istenmeyen sonuçlardan ve gidişatı düzeltemeyen veya temizlenemeyen bir tıbbi sistemden biridir.
Bilim orada. Sonuçları gerçek. Ve hepimiz gerçeği bilmeyi hak ediyoruz.
[1] D Jenkinson, “Ardışık 500 Boğmaca Vakasının Doğal Kursu: Genel Uygulama Nüfus Çalışması,” British Medical Journal, cilt. 310 Şubat 1995, s. 299.
[2] Justus Ström, “Boğmacaya Karşı Evrensel Aşılama Her Zaman Haklı mıdır?” İngiliz Tıp Dergisi, 22 Ekim 1960, s. 1186.
[3] Morens, Taubenberger ve Fauci, “Koronavirüsler, influenza virüsleri ve diğer solunum yolu virüsleri için yeni nesil aşıları yeniden düşünmek,” Cell Host ve Microbe, 11 Ocak 2023.
[4] J. D. Cherry, MD, “Boğmaca ve Boğmaca Aşılarının 112 Yıllık Odyssey'i—Yapılan Hatalar ve Geleceğe Etkileri,” Pediatrik Bulaşıcı Hastalıklar Derneği Dergisi, Eylül 2019, s. 334-341, https://sboh.wa.gov/sites/default/files/2022-01/Tab09e-Cherry%20JPIDS%202019.pdf
[5] J. D. Cherry, MD, “Boğmaca ve Boğmaca Aşılarının 112 Yıllık Odyssey'i—Yapılan Hatalar ve Geleceğe Etkileri,” Pediatrik Bulaşıcı Hastalıklar Derneği Dergisi, Eylül 2019, s. 334-341, https://sboh.wa.gov/sites/default/files/2022-01/Tab09e-Cherry%20JPIDS%202019.pdf
[6] J. D. Cherry, MD, “Boğmaca ve Boğmaca Aşılarının 112 Yıllık Odyssey'i—Yapılan Hatalar ve Geleceğe Etkileri,” Pediatrik Bulaşıcı Hastalıklar Derneği Dergisi, Eylül 2019, s. 334-341, https://sboh.wa.gov/sites/default/files/2022-01/Tab09e-Cherry%20JPIDS%202019.pdf
[7] Matthew Smallman-Raynor ve Andrew Cliff, Salgın Britanya Atlası: Yirminci Yüzyıl Resmi, 2012, Oxford University Press, s. 52.